1. 什么是冷冻电子显微镜技术
冷冻电子显微镜技术,也叫冷冻电镜技术,是在低温下使用透射电子显微镜观察样品的显微技术,即把样品冻起来并保持低温放进显微镜里面,用高度相干的电子作为光源从上面照下来,透过样品和附近的冰层,受到散射。我们再利用探测器和透镜系统把散射信号成像记录下来,进行信号处理,得到样品的结构。冷冻电镜技术作为一种重要的结构生物学研究方法,它与X射线晶体学、核磁共振一起构成了高分辨率结构生物学研究的基础。这项技术获得了2017年的诺贝尔化学奖。获奖理由是“开发出冷冻电子显微镜技术(也称为低温电子显微镜技术)用于确定溶液中的生物分子的高分辨率结构”,简化了生物细胞的成像过程,提高了成像质量。

2. 冷冻电子显微镜成像原理
在光学显微镜下,可见光穿过标本就会通过光学透镜进行折射形成图像。电子显微镜与光学显微镜的成像原理基本一样,所不同的是电子显微镜采用电子束作光源,采用80-300kV电子束加速电压,用电磁场作透镜。两者的主要区别是分辨率不同,而影响分辨率的直接因素是光源的波长,即波长越短,分辨率越高。光子的波长大概在500nm左右。电子的波长是光子波长的十万分之一左右。1975年,Henderson通过电子显微镜首次解析得到了分辨率为0.7nm的细菌视紫红质的结构,这些研究确定了细菌视紫红质以及其他膜蛋白,如水通道蛋白的近原子分辨率图。这些研究为许多二十面体病毒的原子分辨率模型的生成奠定了基础。非有机样品的分辨率甚至更高,它们在成像过程中承受的电子剂量比生物材料高得多,而且结构完整。
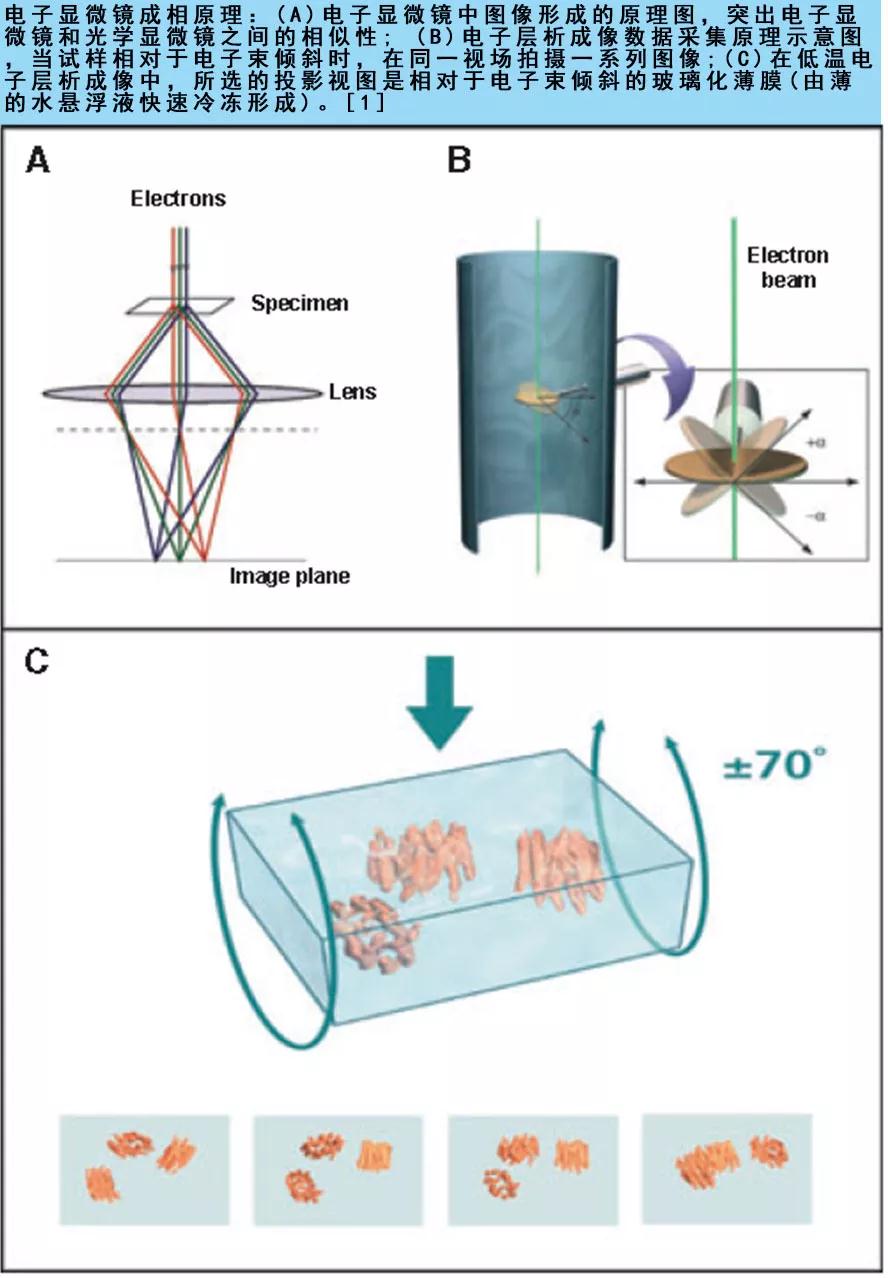
那么,为什么不能在原子分辨率的电子显微镜下,直接对单个蛋白质、病毒和细胞的自然状态进行常规成像呢?
在传统的透射电镜下,一般采用使用负染色法来减轻损伤,即在可接触的分子表面涂上含有重原子的试剂,如醋酸铀酰,这种试剂的辐射敏感性比有机物低得多。通常形成的细胞、病毒和蛋白质图像分辨率在2-4 nm。对未染色标本进行高分辨率成像的困难在于,为了使损伤降低的电子剂量,会产生噪声图像,而电子剂量高到足以获得良好的信噪比时,则会导致标本损伤达到不可接受的程度。
为了解决上述为题,冷冻电镜技术采用了以下两种方法,第一种方法是使用保存在液氮或液氦温度下的冷冻标本进行成像。近40年来,对室温下衍射强度与低温下衍射强度衰减的测量表明,低温电子显微镜可以降低辐射损伤的影响。采用一种在一层玻璃态冰中快速冷冻(玻璃化)生物标本,然后在液氮或氦气温度下成像的方法,使得低温电镜技术得到广泛应用。将水溶液注入液氮冷却的乙烷等冷冻液中,是一种用于制备用于层析成像、单颗粒成像以及螺旋和二维晶体的冷冻电子显微镜样品的方法。与室温下相比,在液氮温度下成像可以减少多达六倍的辐射损伤。这意味着每单位电子剂量的辐射损伤减少,对于低温下记录的图像,可以使用更高的电子剂量来增加信噪比。事实上,液氮和液氦都被成功地用于近原子分辨率的三维重建,在它们的冷却下,分辨率可达大约0.4到2 nm。第二种提高信噪比的方法是对大量同一生物标本单元的图像进行平均。该技术首次应用于螺旋组装体和二维蛋白晶体的室温成像及低温成像。这两个概念,即低温成像的概念和多幅低剂量图像平均的概念,构成了现代高分辨率生物电子显微镜的基础。
3. 冷冻电子断层扫描技术
电子断层成像通过获取同一区域多个角度的投影图来反向重构所研究对象的三维结构,适合于在纳米级尺度上研究不具有结构均一性的蛋白、病毒、细胞器以及它们之间组成的复合体的三维结构。虽然目前电子断层成像所获得的结构的分辨率(约4~10 nm),但其在研究非定形、不对称和不具全同性的生物样品的三维结构和功能中有着不可替代的重要作用。冷冻电子断层成像的适用尺度非常广泛, 包括从分子水平的蛋白质, 到亚细胞水平的细胞器, 以至细胞水平的组织结构。它有效地填补了X- 射线晶体学、核磁共振以及冷冻电镜单颗粒分析等方法得到的高精度结构和光学显微镜技术得到的低分辨率的细胞整体图像之间的空白。
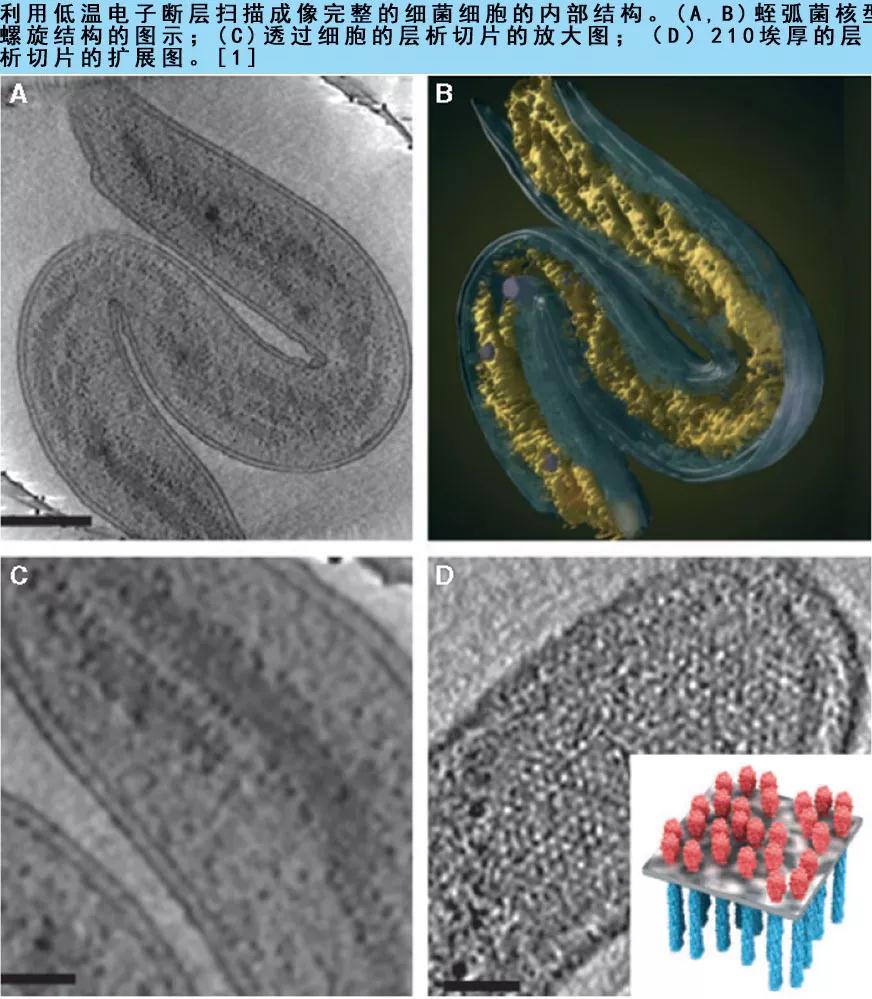
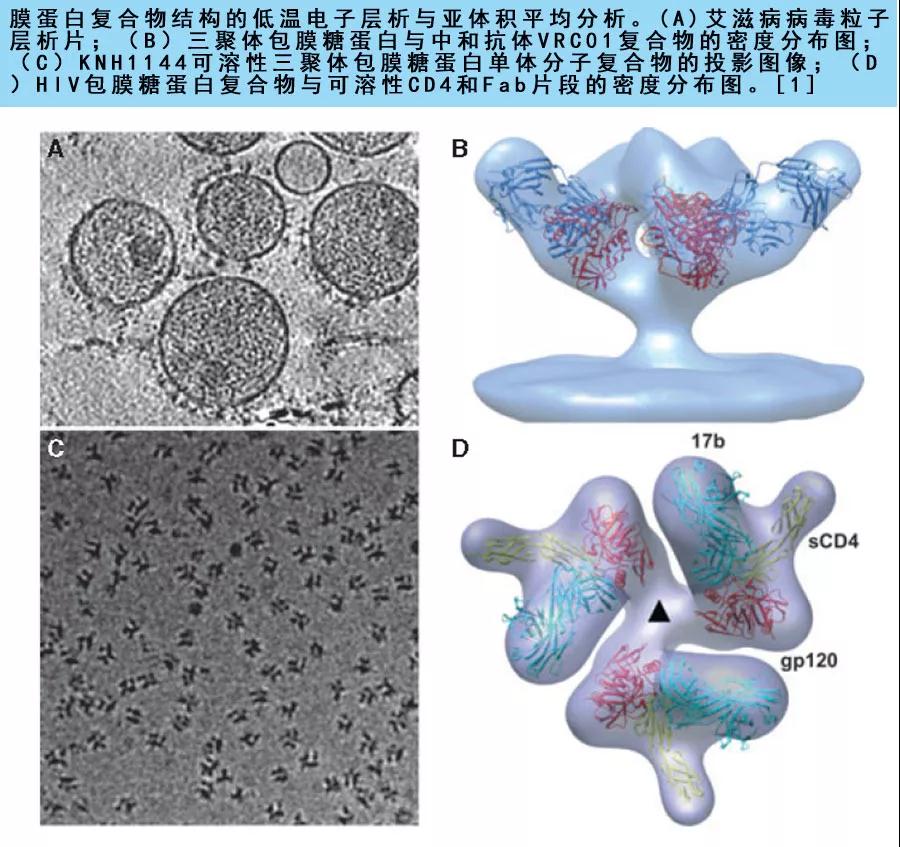
4. 冷冻电镜单颗粒技术
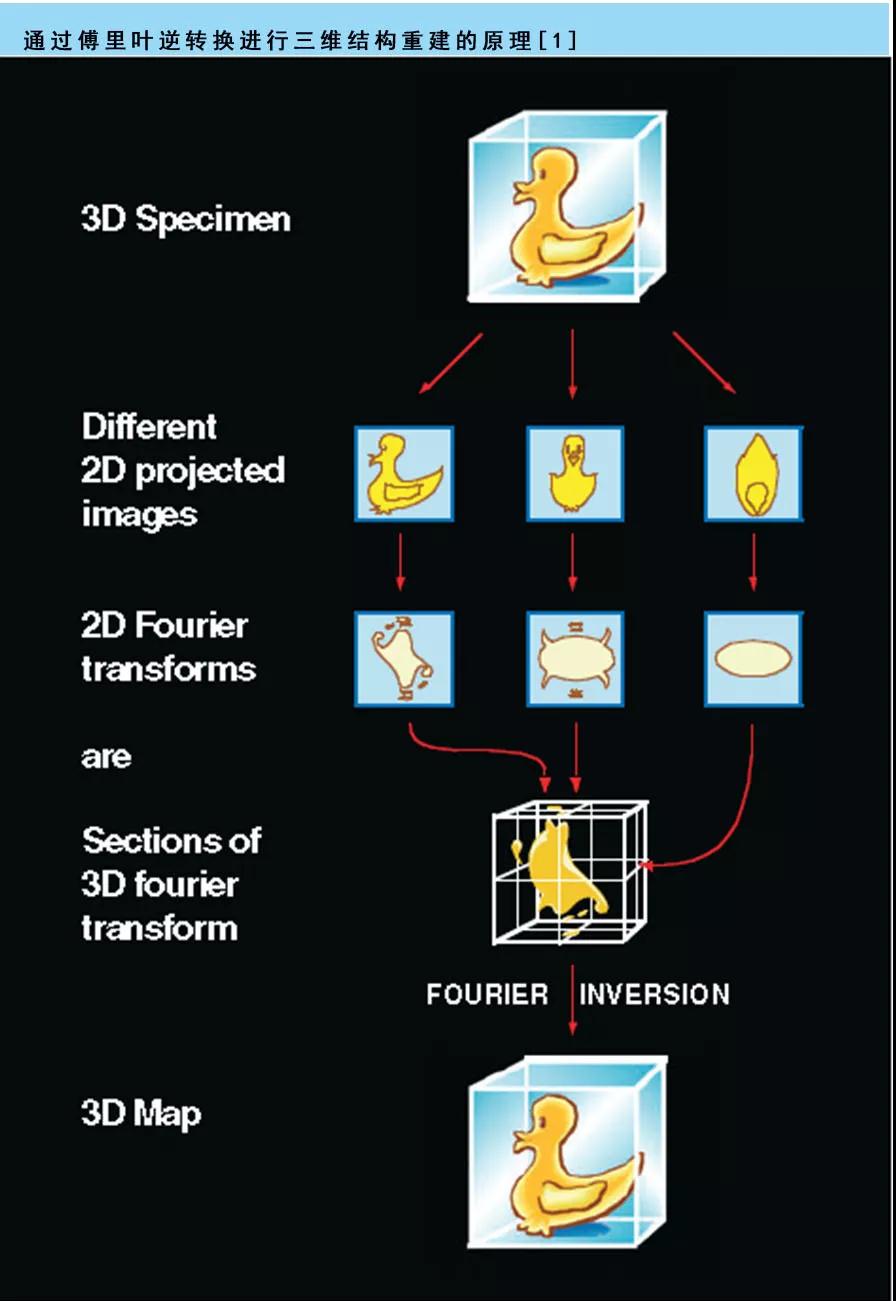
冷冻电镜单颗粒技术利用大量二维投影图像的数据,结合蛋白复合物在不同方向上的相同副本,对结构进行三维重建。和大多数其他低温电子显微镜应用一样,单粒子成像的第一步是将可溶复合物扩散到碳膜的孔上。然后标本被柱塞冷冻,形成一层薄薄的玻璃态冰,理想情况下,这层冰中含有不同方向的复合物的相同副本。冰层的厚度可能从几百埃到几千埃不等,受粒子的尺寸和缓冲区的组成的影响。从含有许多分子复合物的场的图像开始,通过人工或自动算法选择单个粒子。一旦选择统计方法,如主成分分析、多变量分析或协方差分析,可用于根据图像结构特征的变化对其进行排序。从分子复合体的二维电子显微镜投影视图生成三维重建依赖于所有粒子的相对方向。所涉及的步骤在数学上是复杂的,并利用了中心投影定理,该定理指出,对于一个三维对象,每个二维投影的傅里叶变换是通过该对象的三维傅里叶变换得到的一个中心切片(图5)。因此,通过获得数量足够大包含相对于电子束各种各样的方向的分子图像,可以建立3D图像(如图6所示,显示2D图像不同取向的GroEL用于获得其三维结构)。
5. 冷冻电子显微镜技术的突破
在最近几年,冷冻电镜技术的突破主要体现在三个方面。首先是样品制备,通过利用薄膜碳层甚至石墨烯可以用更薄的冰层包裹分子样品来提高信噪比。第二个突破是电子的探测技术,也就是电子探测器的发明。在300 keV 电子的轰击下,传统的器件都会被高能量打坏,因此在电子探测器出现之前,冷冻电镜中使用的CCD相机需要将电子打在探测器上变成光信号,再通过CCD 把光信号转成电信号后得到图像,“电光—光电”转换的过程降低了信噪比。而现在电子探测器能够直接探测电子数量,同时,互补型金属氧化物半导体(CMOS)感光元件的应用使得探测器支持电影模式(movie mode),可以在一秒钟之内获得几十张投影图片。通过后期对样品进行漂移修正,再把这几十张图片叠加起来,从而大幅提高成像的信噪比。模糊的图像一下子变得清晰,冷冻电镜的分辨率不断上升。第三个突破是计算能力的提高和软件算法的进步。冷冻电镜的模型重构通常需要对几万甚至几十万张投影图片进行分析、组装和优化。这需要先进的计算资源配合有效的算法才能实现。综上所述,冷冻电镜技术不仅提高了空间分辨率,而且可以应用于很多以前不能解决的生物大分子的结构研究。[2]
6. 国内低温电镜发展现状
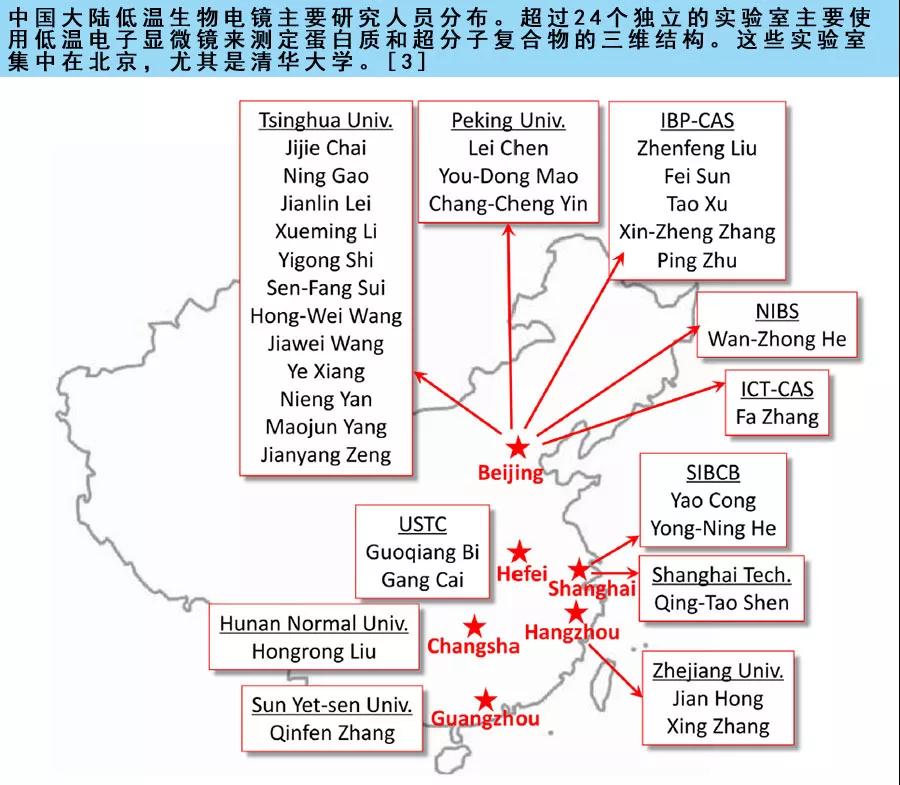
在过去的十年中,中国的生物低温电镜领域得到了极大的发展,从2005年的几个独立实验室发展到2015年的二十多个[3]。 南方科技大学冷冻电镜中心揭牌仪式于2018年11月19日在南科大生物楼举行。对相关科研领域的研究产生更大的影响。
参考文献:
[1] Jacqueline L. S. Milne, Mario J. Borgnia, Alberto Bartesaghi, et al. Cryo-electron microscopy – a primer for the non-microscopist.doi:10.1111/febs.12078
[2] 冷冻电镜单颗粒技术的发展、现状与未来。(来源:中国物理学会期刊网)
[3] Hong-Wei Wang,Jianlin Lei, and Yigong Shi.
Biological cryo-electron microscopy in China.DOI: 10.1002/pro.3018
